Een droge cel is de eenvoudigste vorm van elektriciteitsproducerende bron. Een aantal cellen gecombineerd cellen vormen samen een batterij. De loodzuur of nikkel-cadmium batterij is de geavanceerde versie van droge cel. Deze cel werd voor het eerst uitgevonden door de Franse ingenieur Georges Leclanche in het jaar 1866. Zijn uitvinding werd genoemd naar zijn naam als Leclanche-batterij. Maar in die tijd was het erg zwaar en kon het gemakkelijk worden gebroken. Een droge cel heeft hetzelfde principe en het is de geavanceerde versie van de Leclanche-batterij en wordt geleverd in verschillende spanningen en maten. De commerciële vorm van de zink-koolstofcel, de gemodificeerde vorm van de Leclanche-batterij, werd in 1881 uitgevonden door Carl Gassner uit Mainz. Het wordt in grote hoeveelheden geproduceerd en in veel toepassingen gebruikt, zoals speelgoed, radio's, rekenmachines, enz.
Wat is een droge cel?
Een droge cel is een apparaat dat elektriciteit opwekt op basis van chemische reacties. Wanneer de twee elektroden van de cel via een gesloten pad zijn verbonden, dwingt de cel de elektronen om van het ene uiteinde naar het andere te stromen. De stroom van elektronen zorgt ervoor dat de stroom in het gesloten circuit vloeit.

Droge cellagen
Met behulp van chemische reacties stromen de elektronen van het ene uiteinde naar het andere. Wanneer twee of meer cellen, verbonden met de juiste polariteit, meer elektronen stromen vanwege een hoog potentieel. Deze combinatie wordt een batterij genoemd. Vanaf een minimumspanning van 1,5 V tot 100 V kan een batterij worden gebruikt om een reeks spanningen te verkrijgen. Zelfs de DC-uitgangsspanning van de batterij kan op verschillende niveaus worden geregeld met behulp van elektronische vermogensomzetters zoals bijl circuits.
Structuur van de cel
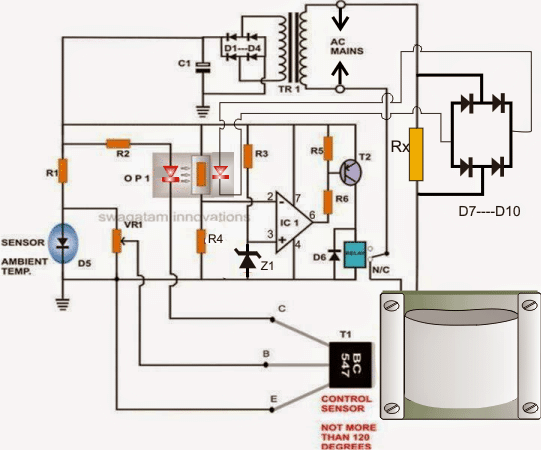
De structuur van de zink-koolstof droge cel is weergegeven in de figuur. Het bestaat uit de anode-aansluiting als zink of in het algemeen grafietstaaf. De koolstof vormt de kathode-aansluiting. Opgemerkt kan worden dat in oudere versies van droge cellen het zink werd gebruikt als kathode en grafiet als anode-aansluiting. De selectie van de elementen is fundamenteel gebaseerd op de chemische configuratie van de buitenste baan van de elementen.

Droge celstructuur
Als het meer aantal elektronen in de buitenste baan heeft, kan het als donor fungeren en dus de kathode vormen. Evenzo, als de buitenste baan minder elektronen heeft, kan deze gemakkelijk de anode opnemen en vormt deze. De tussenliggende elektrolyt fungeert als katalysator voor de chemische reacties. Over het algemeen gebruiken we ammoniumchloridegelei als elektrolyt. In de weergegeven afbeelding is de gebruikte elektrolyt een mengsel van zink en chloride. Ook wordt natriumchloride ook als elektrolyt gebruikt. Een mengsel van mangaandioxide en koolstof is om de anodestaaf omgeven.
De hele configuratie is in een metalen buis geplaatst. Door gebruik te maken van een pek aan de bovenzijde van de cel, wordt voorkomen dat de gelei uitdroogt. Onderaan is een carbon ring geplaatst. Het doel van deze ring is om te voorkomen dat de zinken anodestaaf in contact komt met de container.
Dit wordt ook wel een spacer genoemd, zoals weergegeven in het diagram. De zinken bus is ook omgeven door papieren isolatie voor isolatiedoeleinden. Voor grote batterijen worden ook andere isolatiematerialen zoals mica enz. Gebruikt. De positieve pool van de ell wordt bovenaan gevormd. De negatieve pool van de cel wordt aan de basis gevormd.
Werking van droge cellen
Een droge cel werkt fundamenteel aan chemische reacties. Door de reacties die plaatsvinden tussen de elektrolyt en de elektroden, stromen de elektronen van de ene elektrode naar de andere. Stoffen zoals zuren lossen op in water om geïoniseerde deeltjes te vormen. Het geïoniseerde deeltje is van twee soorten. De positieve ionen worden kationen genoemd en de negatieve ionen worden anionen genoemd. De zuren die in water worden opgelost, worden elektrolyten genoemd.
In het bovengenoemde diagram vormt het zinkchloride als elektrolyt. Evenzo vormt ammoniumchloride-gelei ook als een elektrolyt. De metalen staven die in elektrolyten zijn ondergedompeld, vormen elektroden. Op basis van de chemische eigenschappen van de metalen staven hebben we een positieve elektrode als anode en een negatieve elektrode als kathode.
De elektroden trekken de tegengesteld geladen ionen naar hun kant. De kathode trekt bijvoorbeeld de anionen aan en de anode de kationen. In dit proces stromen de elektronen van de ene richting naar de andere, waardoor we een ladingsstroom krijgen. Dit heet stroom
Chemische reacties
De reacties die plaatsvinden in de cel worden hieronder weergegeven. De eerste is de oxidatiereactie.

Hierbij wordt de zinkkathode geoxideerd tot positief geladen zinkionen waarbij twee ionen vrijkomen. Deze elektronen worden opgevangen door de anode. Dan komt de reductiereactie.

De reductiereactie aan de anode is hierboven weergegeven. Deze reactie produceert een elektrische stroom. Het geeft oxide-ionen af met magnesiumoxide. Deze reactie ontstaat wanneer magnesium wordt gecombineerd met de elektrolyt.


De andere twee reacties vertegenwoordigen een zuur-base-reactie en precipitatiereactie die plaatsvinden in de droge cel. In de zuur-base-reactie wordt NH gecombineerd met OH om samen met water NH3 te produceren. De uitkomsten zijn NH3 en waterbasis.
Verschil tussen een droge cel en een natte cel
Het belangrijkste verschil tussen de droge cel en de natte cel is de vorm van elektrolyt. Zoals eerder besproken, is in een droge cel de elektrolyt zoals ammoniumchloride droog van aard. Dergelijke droge cellen komen vaker voor en worden gebruikt in speelgoed, radio's, enz. Maar in een natte cel bevindt de elektrolyt zich in de vloeibare toestand.
Vloeibare elektrolyten zoals zwavelzuur, een gevaarlijke corrosieve vloeistof, worden gebruikt. Vanwege de aard van dergelijke vloeistoffen is de natte cel explosiever van aard en moet deze met zorg worden behandeld. Het beste voordeel van dergelijke natte cellen is dat ze gemakkelijk kunnen worden opgeladen en voor talloze toepassingen kunnen worden gebruikt. Dergelijke batterijen worden veel gebruikt in de luchtvaart, nutsbedrijven, energieopslag en gsm-torens.
Droge celfuncties
De droge celfunctie gebaseerd op de chemische reacties tussen de elektrode en de elektrolyten. Wanneer de elektroden in de elektrolyten worden geplaatst, trekt het de tegengesteld geladen ionen naar zich toe. Dit veroorzaakt de stroom van ladingen, en dus wordt er stroom geproduceerd.
Voordelen
De voordelen van de droge cel omvatten de volgende.
- De droge cel heeft tal van voordelen zoals
- Het is klein van formaat.
- Het kan in verschillende spanningsniveaus komen.
- Het is handig en heeft tal van toepassingen.
- Het is de enige bron van gelijkspanning.
- Het kan samen met vermogenselektronische circuits worden gebruikt om de uitgangsspanning te regelen
- Hij is oplaadbaar.
Nadelen
De nadelen van de droge cel omvatten de volgende.
- Er moet voorzichtig mee worden omgegaan
- Het is explosief
- Batterijen met een grote capaciteit zijn erg zwaar
Toepassingen
De toepassingen van de droge cel omvatten de volgende.
- Speelgoed
- Luchtvaart
- Telefoons
- Radio
- Rekenmachine
- Horloges
- Gehoorapparaten
Daarom hebben we de werking, classificatie en toepassingen van het droge cellen Een interessant punt om op te merken is dat de batterij alleen werkt als de elektroden fysiek met elkaar in contact zijn. Er moet een geleidend medium zijn tussen de twee elektroden. De vraag is: kan water worden gebruikt als een geleidend medium tussen de elektroden van de droge cel? Wat gebeurt er dan als deze cel in water wordt gedompeld?